2024 노벨화학상 수상자 소개
: 단백질 디자인, 알파폴드 그리고 구글?
안녕하세요 여러분
다양한 의약품을 과학의 눈으로 분석하는 이오형입니다.
어제부로 노벨상의 과학적 부문에 대한 발표가 끝났습니다.
과학분야에 주어지는 상으로는
노벨 물리학상, 노벨 화학상,
그리고 노벨생리의학상이 있죠?
이 중, 노벨화학상과 노벨 생리의학상 수상은 모두 바이오 제약업계와 직접적인 연관이 있는 분야가 나오게 되었습니다.
오늘은 먼저 노벨 화학상을 수상한 과학자들과
이들의 이야기에 대한 업계사람의
간단한 인식을 말씀드리려고 합니다.
참고로 작년에 이어서 올해의 노벨 화학상도
전통적인 "화학"이라기보다는
생물학에 가까운 분야가 받았네요.
그럼 먼저 노벨화학상 수상자가 누구인지부터 말씀드리겠습니다.
2024 노벨 화학상 수상자
올해의 노벨 화학상 수상자는 총 세 명입니다.
David Baker 1/2
Demis Hassabis 1/4
John Jumper 1/4
이렇게 받았습니다.

즉 두 분야에 수여되었다고 보면 되는데,
David Baker는 단백질 디자인 부문으로 받았고,
Demis Hassabis와 John Jumper는 AI를 이용한 단백질구조예측 부문으로 받은 것입니다.
(참고로 노벨물리학상도 AI연관분야가 받았습니다.. 참 AI의 영향력이 대단함을 느낍니다.)
둘 다 실험적인 방법 없이 단백질 구조를 예측하고, 단백질을 디자인할 수 있게 한 공로죠.
이들의 공로를 이해하기 위해서는 구조생물학 이라는 분야에 대한 이야기를 먼저 하고자 합니다.
구조생물학
구조 생물학은 말 그대로 생물학적 분자의 구조를 눈으로 볼 수 있게 하는 분야입니다.
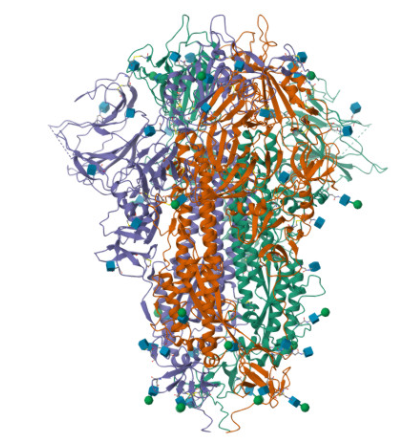
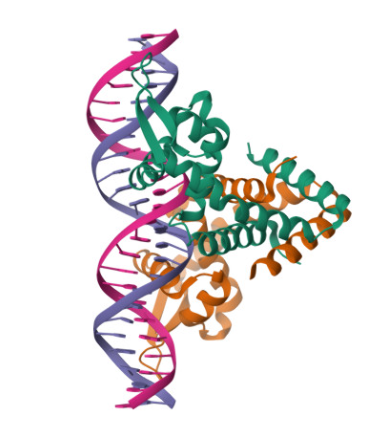
생물학적 분자라고 하면 DNA나 단백질 등이 있는데,
이들이 실제로 3차원 공간에 어떤 모양으로 있는지를 보려고 하는 분야입니다.
인간의 세포 중 가장 큰 난자가 맨눈으로 겨우겨우 형체만 보일 정도인데,
이런 세포 안에 가득 들어있는 단백질은 얼마나 작을까요?
실제로 단백질 분자의 사이즈는 나노미터단위입니다.
즉 일반적인 현미경으로는 볼 수 없고,
일반적인 가시광선으로도 볼 수 없습니다.
그래서 아주 파장이 짧고 에너지가 강한 빛을 이용해서 봐야합니다.
X선을 이용해서 구조를 보는 것이 X-ray crystallography (X선 분광결정학)
전자선을 이용해 구조를 보는 것이 cryo-EM입니다.
이렇게 크리스탈분야와 cryo EM분야가 구조생물학의 양대 산맥을 이루고 있고,
그 외에 NMR과 같은 부가적인 방법이 있습니다.
참고로 X ray분야는 1915년 노벨물리학상을 받았고,
cryo-EM분야는 2016년 노벨화학상을 받았습니다.
노벨상을 받을 만큼 위대한 방법론들 덕분에 구조생물학 분야는 빠르게 발전했습니다.
이제 왠만한 단백질은 어떻게 생겼는지 대략 알고 있습니다.
그런데, 이런 방법을 써도 여전히 구조를 모르는 단백질이 있습니다.
이들은 엄청난 노력을 해도 방법론적인 한계 때문에 진전이 안 되는 경우입니다.
그래서 구조생물학 분야는 어느 순간부터는 새로운 지식의 발굴이라기보다는,
산업적 이용을 확대하고 있는 분야이기도 합니다.
구조생물학과 신약개발
구조생물학은 현재 의약품 개발에 아주 중요한 역할을 하고 있습니다.
왜냐하면 지금까지 우리가 먹은 약 중에
정확하게 어떤 원리로 약효를 나타내는지
모르는 약들이 정말 많습니다.
사실상 과거부터 먹고 있는 화합물 약은
왜 약효를 나타내는지 잘 모르고 있습니다.
그냥 화합물 스크리닝해보니 효과가 있는 것 같아서 동물실험하고,
임상시험해서 약으로 사용하는 경우가 아주아주 많습니다.
그렇다 보니 부작용이 많기도 하고,
또 생각지도 못한 부가적 효과를 얻어서
다른 용도로 쓰이기도 하는 등의
일들이 많아지고 있습니다.
요즘 제약의 트렌드는 MoA가 명확한 약,
즉 이 병이 어떤 문제에 의해 생기는지 알고
이 약이 그 문제를 어떻게 해결하는지 아는
그런 약들이 주목받는 것입니다.
여기에 꼭 필요한 기술로 구조생물학이 주목받고 있습니다.
구조생물학을 통해서 원하는 단백질의 구조를 명확히 파악하고,
이 구조를 어떻게 바꾸는 약을 디자인할 것인가를 결정할 수 있기 때문입니다.
이런 방식의 제약을 Rational Drug Design이라고 해서
Vertex Pharma에서 주도하고 있다는 이야기도 드렸었습니다.
DeepMind의 알파폴드
알파폴드는 이 분야 사람이 아니라고 해도,
AI 쪽 투자에 관심이 있는 분들은 다들 들어보셨을 거예요.
바둑천재 이세돌을 이긴 알파고의 개발사인
구글의 DeppMind사가 개발한 프로그램입니다.
한마디로 말하면 서열만 갖고 단백질의 구조를 예측하는 프로그램입니다.

말로만 들으면 정말 쉬울 것 같지만,
이것은 정말로 어려운 일입니다.
간단하게 생각해서 100개의 아미노산으로 이뤄진 단백질을 생각해 볼게요.
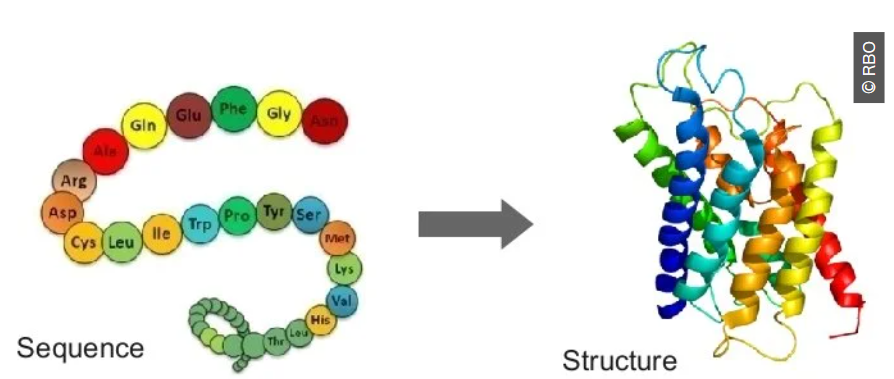
그렇다면 99개의 연결이 있을 것이고,
각각의 연결은 360도 방향 중에 어떤 방향성을 가질지 알아야 합니다.
또한 하나의 아미노산 안에서도 작용기가 어떤 방향으로 뻗어 있을지 생각해야 하고,
멀리 떨어진 아미노산이 가까이 접혀서 상호작용하는 것도 고려해야 합니다.
즉 어마어마한 계산이 필요한 일입니다.
대신 이걸 할 수만 있다면 귀찮고 돈이 많이 드는
기존 구조생물학을 대체할 수 있겠죠?
그래서 이러한 목표를 갖고 CASP라는 대회가 열렸습니다.
단백질 서열만 가지고 3D구조를 가장 정확하게 예측하는 팀이 우승을 하는 대회죠.
13회 CASP에서 2위와 압도적인 차이로 정확하게 구조를 예측한 우승자가 나왔습니다.
바로 DeepMind사의 AlphaFold1이 1등을 했습니다.
기존 단백질 구조 예측방법은 물리학적인 장을 간소화시켜서 계산하는 방법들이 지배적이었는데,
알파폴드는 딥러닝을 이용해 단백질 구조예측을 했습니다.
이후 이를 업그레이드한 AlphaFold2가 CASP14회에서 또 우승을 하게 됩니다.
이후 단백질 구조예측분야는 거의 다 AI기반으로 바뀌게 되었습니다.
사실상 단백질 구조예측분야의 지각변동을 일으킨 것이죠.
AI로 단백질 구조예측을 하자는 아이디어를 최초로 만든 것은 아니지만,
아주 연산이 많이 필요한 이 분야의 계산을
어떤 알고리즘을 이용해 효과적으로 할지를 제시했으니
정말 대단한 성과라고 할 수 있습니다.
P-NP의 경계선에 있던 단백질 구조예측 분야를
NP problem에서 P problem 쪽으로 이끈
혁명적인 알고리즘이라고 볼 수 있겠죠?
DeepMind의 문제점
그런데 딥마인드 사는 회사입니다.
이윤을 추구하는 곳이죠.
다른 연구팀들은 보통 대학의 연구팀입니다.
과학, 즉 인류의 지식을 증진시키는 목적을 갖고 있습니다.
구글의 자회사 딥마인드는
당연히 이렇게 좋은 기술을 무료로 풀지 않겠죠?
그래서 처음에는 소스코드도 공개하지 않고,
프로그램도 공개하지 않고 팔아먹으려고만 했습니다.
그런데 딥마인드는 그러면 안 됩니다.
왜냐하면 딥러닝자체가 이미 과학자들이 실험적인 방법론을 통해서
구조를 풀어놓은 데이터를 이용해서 학습시킨 프로그램이거든요.
아무리 학습 알고리즘이 위대하다고 해도,
오픈소스인 PDB파일을 이용해서 만들어놓고
소스코드를 공개하지 않는 게 윤리적일까요?
그래서 초기엔 비판을 받기도 했습니다.
어쨌든 딥마인드 사는 계속해서 AlphaFold2의 코드를 공개하지 않다가,
2021년 어떤 사건에 의해서 공개를 결정하게 됩니다.
이 사건에 대해서는 밑에서 더 자세히 설명드릴게요.
David Baker 의 단백질 디자인
David Baker는 미국 워싱턴대의 교수입니다.

베이커는 ROSETTA라는 프로그램을 개발했고,
사실상 단백질 디자인 분야의 초석을 닦은 거나 마찬가지인 사람입니다.
현재는 Institude of Protein Design (IPD)라는 기관을 운영하고 있습니다.

ROSETTA라고 하는 프로그램은 일반인을 대상으로 하는 프로그램은 아니고
이쪽 분야 전문가들이 사용하는 프로그램인데,
간단하게 말씀드리면 force field라는 것을 이용해서
가상의 공간에서 단백질을 시뮬레이션하는 프로그램이라 이해하시면 쉽습니다.
이걸 이용해서 단백질의 구조를 예측해 보기도 하고,
단백질 간의 상호작용을 계산해보기도 하는 프로그램이죠.
이 프로그램을 계속해서 발전시킨 것이 그의 업적이라고 할 수 있습니다.
베이커는 이 ROSETTA를 이용해 아주 다양한 업적을 이뤘습니다.
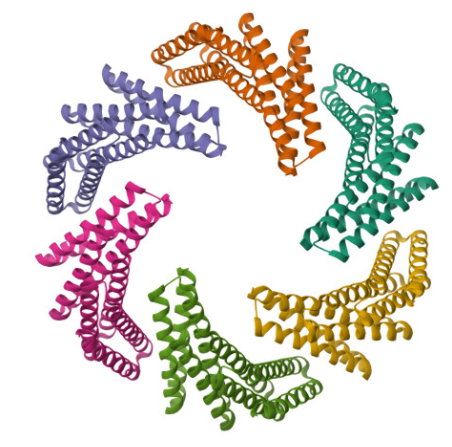
self-assembly 가 되는 단백질을 만들어 약 캐리어로 만들기도 하고,
mini-binder라는 항체의 단점을 극복한 초소형단백질을 만들기도 했습니다.
이제 어렵고 귀찮은 항체스크리닝을 할 필요가 없어졌습니다.
구조만 알고 있다면 누구나 쉽게 항체 같은 단백질을 만들 수 있죠.
또한 실험적인 구조생물학 분야도 이러한 프로그램에 많은 도움을 받고 있다고 합니다.
David Baker팀의 또 다른 업적
그러다가 2022년, 대박사건이 일어납니다.
바로 RosseTTAFold라는 것이 만들어집니다.
이게 무엇이냐면 AI기반의 단백질구조예측 프로그램인데,
DeepMind에서 개발한 AlphaFold급으로 정확한 프로그램입니다.
DeepMind는 소스코드를 공개하지 않았는데,
베이커 연구팀은 학술적인 팀이죠?
그래서 바로 논문을 내고 코드도 공개해 버립니다.

과학계의 근본 저널, Science 지에 나옵니다.
참고로 1 저자는 서울대 교수이신 백민경교수님입니다.
(저 논문내고 몇 년 뒤에 바로 서울대로 오셨습니다)
그리고 교신저자로 David Baker 보이시죠?
RoseTTAFold의 공개 이후 더 이상 사람들은
비싼 돈 내고 AlphaFold를 쓸 필요가 없어진 것이죠.
이 일 이후로 AlphaFold2가 공개되었습니다.
이렇게 되어서 알파폴드가 대중에게 공개되었습니다.
2024 노벨화학상 정리
그럼 이상으로 이번 노벨 화학상이 어떤 분야의 어떤 사람들에게 주어졌는지 다시 정리해 드리겠습니다.
구조생물학 분야는 어느 순간 방법론적 어려움으로 멈춰있었습니다.
그러던 중, 단백질 디자인과 단백질 구조예측이라는 방법이 들어왔습니다.
이 방법은 실험적으로 어려운 일을 쉽고 경제적으로 성공해 냈습니다.
새로운 방법론이 생겼으니 이제 새로운 과학이 열리겠죠?
구조생물학이 제약업계에 새로운 바람을 불러왔 듯,
Rosetta와 AlphaFold 가 제약업계에 또 어떤 새로운 아이디어를 제시할 지 기대가 됩니다.
정말 언젠가는 모든 병의 치료제가 나오지 않을까 하는 기대가 되네요.
앞으로 베이커교수의 연구가 어떻게 전개될지,
DeepMind 사는 어떤 새로운 프로그램을 만들지
아주 기대가 되네요.
이상 2024노벨 화학상에 대한
제약관련종사자의 간단한 사견이었습니다.
2024노벨생리의학상에 대한 제 분석이
궁금하신 분들은여기를 참고해주세요
https://dueffect.tistory.com/111
2024 노벨생리의학상 수상자 소개 : microRNA가 뭐길래? 진단키트, 신약, 그리고 연구
2024 노벨생리의학상 수상자 소개 : microRNA가 뭐길래?- 진단키트, 신약, 그리고 연구 안녕하세요 여러분다양한 의약품을 과학의 눈으로 분석하는 이오형입니다. 저번 포스팅에 이어
dueffect.tistory.com
'이슈를 바이오의 눈으로 보다' 카테고리의 다른 글
| 2024 바이오시밀러 신약 알아보기 (8) | 2024.11.02 |
|---|---|
| 2024 노벨생리의학상 수상자 소개 : microRNA가 뭐길래? 진단키트, 신약, 그리고 연구 (7) | 2024.10.11 |
| 새로운 진통제 시장이 열릴까? 수제트리진 : Suzetrigine (1) | 2024.08.16 |
| 치매약, 논란의 연속들 - 레켐비, 그리고 일라이 릴리의 신약 (0) | 2024.06.17 |
| mRNA 백신을 맞으면 엉뚱한 단백질이 생긴다? Nature mRNA 백신 위험성 논문 분석 (2) | 2024.03.04 |